可用性工程專家培訓系列四部曲
醫療器材人因/可用性工程簡單來說就是專注於產品使用者界面之設計開發、風險分析..
醫療器材人因/可用性工程簡單來說就是專注於產品使用者界面之設計開發、風險分析、風險管制、風險管制措施驗證的程序。 IEC 62366-1法規標準要求製造商在設計管制中同時建立可用性活動,透過分析與評估產品於可用性方面的潛在危害,以設計的方法將風險降低至可接受的範圍,同時留下文件紀錄(可用性工程檔案),包括測試計畫與報告。 醫療器材開發過程中若沒有導入可用性工程,將無法向主管機關證明你有找出潛在的使用相關危害,甚至會遺漏了傷害嚴重度高並與使用相關的系統性風險,而對商業上的影響則是可能讓使用者失去對產品的信任。


| 課程代碼2321090032 可用性工程專家培訓系列四部曲 課程型態/混成(實體+線上同步) 上課地址/台北館前聯合大樓,詳細上課地點請依上課通知 時數/24小時 起迄日期/2022/03/12~2022/08/06 聯絡資訊/陳小姐 03-5732407 |
課程介紹醫療器材人因/可用性工程簡單來說就是專注於產品使用者界面之設計開發、風險分析、風險管制、風險管制措施驗證的程序。
IEC 62366-1法規標準要求製造商在設計管制中同時建立可用性活動,透過分析與評估產品於可用性方面的潛在危害,以設計的方法將風險降低至可接受的範圍,同時留下文件紀錄(可用性工程檔案),包括測試計畫與報告。
醫療器材開發過程中若沒有導入可用性工程,將無法向主管機關證明你有找出潛在的使用相關危害,甚至會遺漏了傷害嚴重度高並與使用相關的系統性風險,而對商業上的影響則是可能讓使用者失去對產品的信任。
IEC 62366-1:2015+A1:2020是為了與新版ISO 14971:2019風險管理更完美地整合,而發行的A1小改版。本課程透過最新版的標準,說明歐盟MDR與美國FDA對於可用性工程的要求。
要將IEC 62366-1整合並可執行在設計開發上,可能讀完標準還不夠,標準無法真正幫助你設計出好產品,標準只是協助我們建立流程。因此本系列課程將可用性工程分成四堂課(可分開選課):
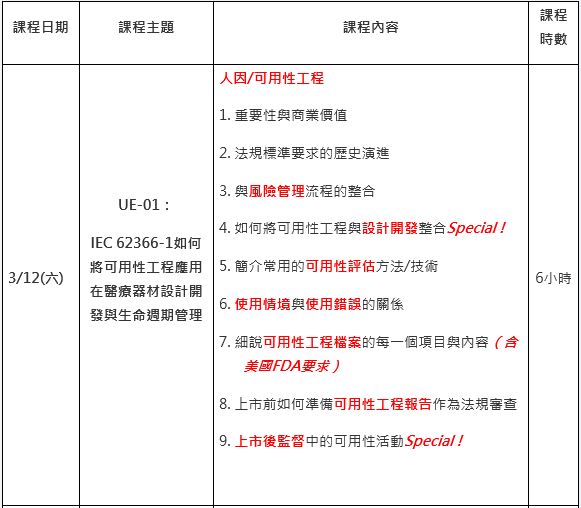
− UE-01:IEC 62366-1如何將可用性工程應用在醫療器材設計開發與生命週期管理
− UE-02:醫療器材可用性評估方法與技術
− UE-03:設計與撰寫一份友善的使用說明書
− UE-04:運用可用性設計降低使用風險
講師以多年可用性研究、實作、主持可用性測試的經驗,設計此課程。
*工研院產業學院為衛福部核可辦理醫材人員訓練及認證之合格單位,本課程完訓後可申請時數認證,惟實際申請仍以衛福部查核結果為準,敬請學員踴躍報名。 *因應中央疫情防疫規定,本場次課程將以「實體舉辦」為主,後續將視中央疫情規定保留調整為「線上辦理」之權利,實際上課資訊請依上課通知為準。 課程目標− 懂得如何將可用性工程與設計開發、風險管理、上市後監督等流程做整合。
− 了解如何在產品生命週期管理中運用可用性工程,建立與維護可用性工程檔案。
− 讓可用性工程,變成我的朋友而不只是法規要求。
課程對象從事醫療器材產品/專案經理、市場/研發/製造/品保/法規人員、產品專員、新創公司產品設計團隊等。
講師簡介俞力平 博士 (Irving Yu)− 樂證科技資深顧問 / EU MDR法規長
− 醫療器材法規小學堂
− 專長:歐盟MDR、安全與風險管理、可用性工程、設計管制
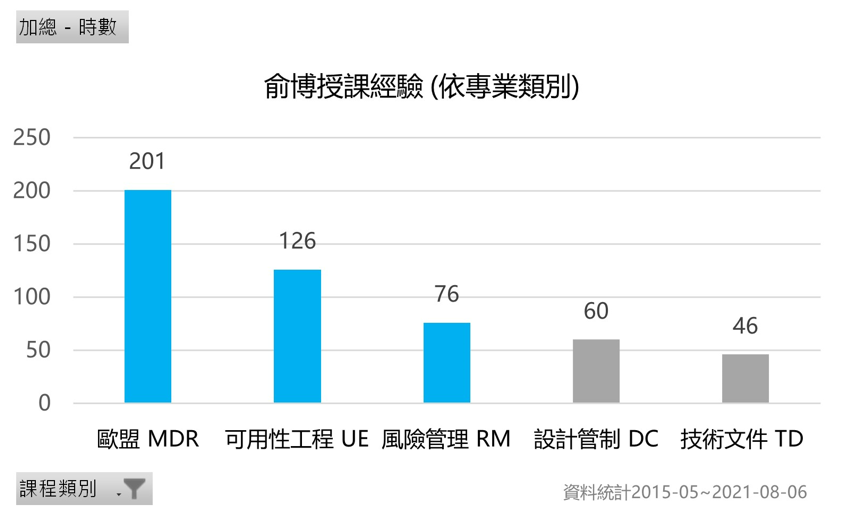
授課經驗: 課程範圍
課程大綱
課程特色
本課程分為4個主題,可自由挑選合適主題受訓:
課程售價n 單堂 特惠價:每人$4,800元整 (原價$6,000元)
早鳥優惠價:開課前14天報名優惠價:每人$4,600元整
工研人優惠價:每人$ 4,500元整
同單位2人團報優惠價:每人$ 4,200元整
同單位3人(含以上)團報優惠價:每人$ 3,950元整
n 4堂可用性工程專家培訓系列包套更優惠! 特惠價:每人$16,000元整(平均單堂$4,000元)
早鳥優惠價:開課前14天優惠價:每人$15,200元整(平均單堂$3,800元)
同單位2人(含以上)團報優惠價:每人$13,200元整(平均單堂$3,300元)
※本課程歡迎企業包班,敬請企業來電洽詢課程承辦人。
付款方式(一)ATM轉帳(線上報名):
繳費方式選擇「ATM轉帳」者,系統將給您一組虛擬帳號「銀行代號、轉帳帳號」,此帳號只提供本次課程轉帳使用,各別學員轉帳請使用不同轉帳帳號。
(二)信用卡(線上報名):
繳費方式選「信用卡」,直到顯示「您已完成報名手續」為止,才確實完成繳費。
(三)銀行匯款(公司或個人電匯付款):
主辦單位將於確認開班後通知您相關匯款帳號,請您繳費後回傳相關收據給 itri536183@itri.org.tw 陳小姐。
貼心提醒※以下注意事項 ─ 敬請欲報名者多多協助,感謝您!
1. 為確保您的上課權益,報名後若未收到任何回覆,請來電洽詢方完成報名。
2. 若報名者不克參加者,可指派其他人參加,並於開課前2日通知。
3. 因課前教材、講義及餐點之準備,若您不克前來須取消報名,請於開課前3日以E-mail或電話通知主辦單位聯絡人確認申請退費事宜,學員於開訓前退訓者,將依其申請退還所繳上課費用90%,另於培訓期間若因個人因素無法繼續參與課程,將依上課未逾總時數1/3,退還所繳上課費用之50%,上課逾總時數1/3,恕不退費。
4. 為尊重講師之智慧財產權益,無法提供課程講義電子檔。
5. 為配合講師時間或臨時突發事件,主辦單位有調整日期或更換講師之權利。
6. 繳費方式為信用卡、ATM轉帳,無法受理現場報名和繳費。
|
簡介
產業學院緣起
依據行政院「挑戰2008:國家發展重點計畫」下之「國際創新研發基地」與「產業高值化」兩計畫,首重產業科技人才的效能。
•911216經科字第09103373120號函:經濟部將本院籌設工研院產業學院之工作,列為因應產業結構轉型,提 ... more