生技製藥PIC/S GMP/GDP品質管理及建廠
將主要著力於PIC/S GMP及PIC/S GDP品質管理及區域設計重點

課程總覽 生技醫藥 課程代號:2324110003 確定開班 生技製藥PIC/S GMP/GDP品質管理及建廠、確效及文件建構管理師培訓班(全系列) PIC/S GMP及PIC/S GDP是兩套目前製藥及生技產業最重要的規範標準,在進行硬體改善以符合規範要求前,就應導入適當之品質管理文件,讓軟硬體同步到位。 課程型態/ 混成 上課地址/ 中科_工商行服務大樓4樓或9樓教室 或 WEBEX線上直播 時 數/ 30 小時 起迄日期/ 2025/02/14 ~ 2025/02/22 聯絡資訊/ 陳文幸 04-25672316 報名截止日期:2025/02/21 |
|||||||||||||||||||||||||||||
.jpg) 課程內容PIC/S GMP及PIC/S GDP是目前製藥及生技產業對於製造行為與運銷管制中,兩套最重要的規範標準,在進行硬體改善符合法規要求前,就應熟讀基礎法規的門檻要求並導入適當之品質管理文件,讓軟硬體同步到位。
單元一:主要著力於PIC/S GMP及PIC/S GDP品質管理及區域設計重點實務解說,使學員了解兩套目前最重要的規範標準,藉由此次法規重點精華說明,將最新PIC/S GMP導入於現行作業範疇中,確認流程與作業方法均能符合要求,並且清楚認知廠房及支援系統規範,為何需滿足設計、建造、調適及維護要求後,進而導入風險管理措施以設計或再次審閱相關設施系統,審視是否真正滿足目前最新法規要求,避免因法規觀念日益更新,導致廠房及設備也必須被迫要求一直修正或更新。建立GMP生技藥品生產作業環境後,亦需符合PIC/S GDP規範,以風險管理立場,規範倉儲區域環境溫溼度與及管理含運銷商整體在內之運銷流程,以落實保證藥物品質。
單元二:主要藉由此次品質管理文件重點解說,輕鬆瞭解PIC/S GMP中所要求,至少之十大管制程序及五大管理標準之文件撰寫要領。並且於熟悉基本文件內容後,再學習何謂驗證及何謂確效,並將驗證及確效流程以一清晰易懂且符合規範之文件予以紀錄,以確實呼應目前PIC/S GMP規範要求,並藉由完善之品質管理文件建構,進而確認審閱相關設施系統均確實符合目前最新法規要求。完成PIC/GMP主要文件建構後,更需要符合PIC/S GDP規範,因此GDP文件建構亦是一主要需求。
課程模組
符合~品質被授權人(Authorized Person,AP)相關規定上課時數 *本課程歡迎企業包班 ~請來電洽詢 課程承辦人陳小姐(Joan) 04-25675621,謝謝! ●本課程符合勞委會"協助事業單位人力資源提升計畫"的補助方案,歡迎企業踴躍報名參加。 ◆以下為【生技製藥系列】~歡迎您一同報名參加:(點選課程名稱可連結至課程)
課程(單元一)
課程(單元二)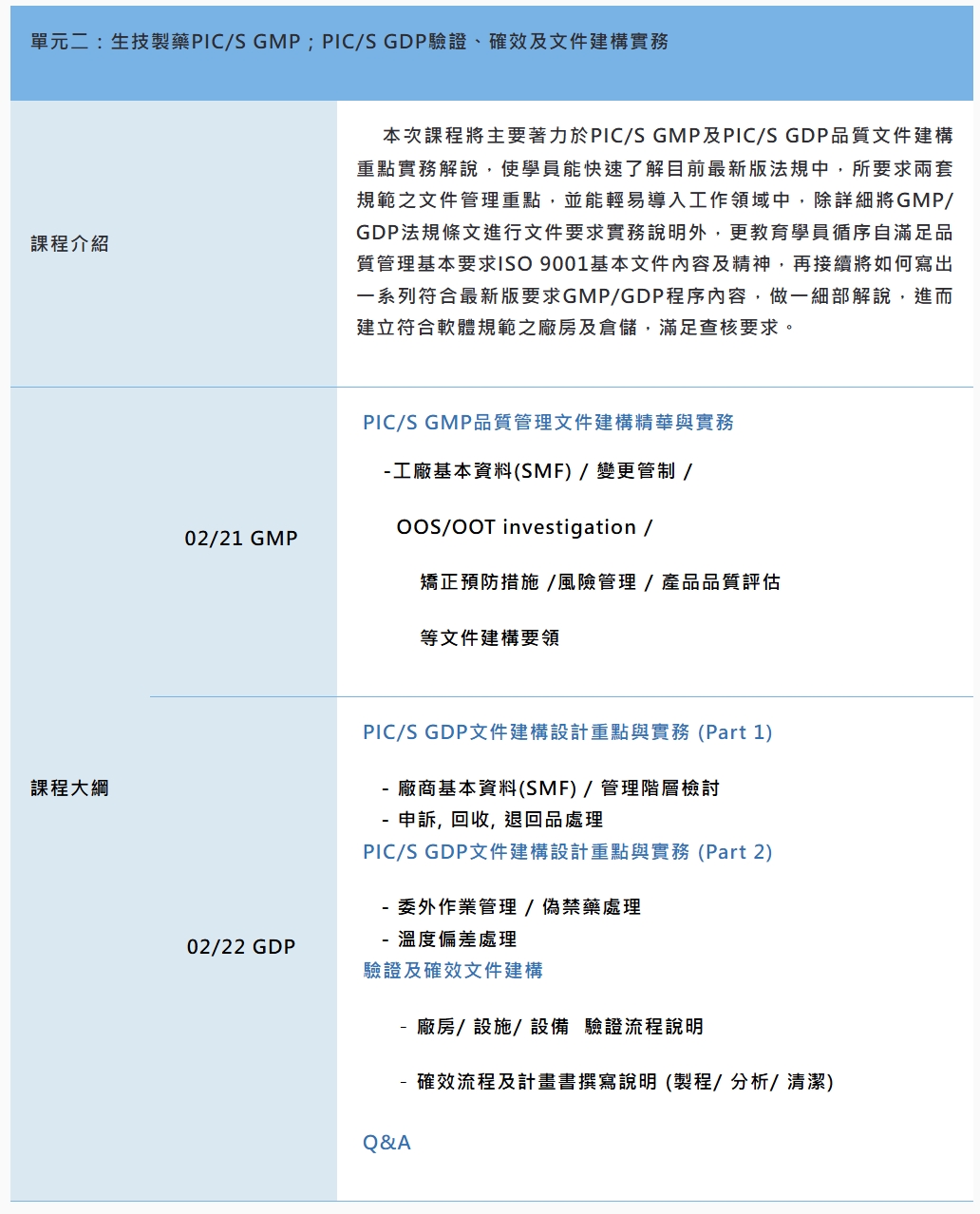 |
|||||||||||||||||||||||||||||
課程剪影
|
|||||||||||||||||||||||||||||
課程對象符合~品質被授權人(Authorized Person,AP)相關規定上課時數 1.生技藥品、中草藥、保健食品及化妝品產業之製造/廠務/倉儲人員。 2.生技藥品、中草藥、保健食品及化妝品等生技藥廠品保/品管人員。 3.尚未實施尚未實施PIC/S GMP/GDP之業者。 4.已通過PIC/S GMP/GDP廠之品保、品管、製造等人員。 5.欲深入瞭解PIC/S GMP/GDP之各界先進或有興趣者。 講師簡介工研院-特聘業界專業講師 經歷: 1. 具藥廠QA/QC經驗15年以上,且具生產及建廠實務經驗。 2. 協助公司建置符合PIC/S GMP規範之藥廠,並于102年順利通過取得行政院衞生署食品藥物管理局PIC/S GMP評鑑結訓證書- 凡參加<生技藥品產業PIC/S GMP/GDP品質管理及廠房設計實務>或 <生技製藥PIC/S GMP/GDP驗證、確效及文件建構實務> 或 <全系列> 之學員 1. 研習期滿,出席率超過80%(含)以上。 2. 參加實務討論者,即可獲得工研院頒發之培訓證書。 課程費用
●本課程符合勞委會"協助事業單位人力資源提升計畫"的補助方案,歡迎企業踴躍報名參加 ●符合~品質被授權人(Authorized Person,AP)相關規定上課時數
報名方式
(可單元報名或全系列報名) ●上課日期:114/02/14、02/15、02/21、02/22(週五、六) ----------- ----------- 2.電子郵件報名:E-mail:itri533882@itri.org.tw ●課程洽詢:(04)2567-2316 /(04)2568-7661 陳小姐
數位專區
◆以下注意事項─敬請您的協助,謝謝! 【實體/線上同步課程】 為確保您的上課權益,報名後若未收到任何回覆,敬請來電洽詢方完成報名。 1、本課程為數位課程,待報名且繳款完成,並由課程承辦人確認收款無誤後,將開通帳號以及提供觀看連結予學員,學員將於付費之觀看期間內(即帳號開通後90天內),享無限次數觀看權限。 ------------ 附件
|
|||||||||||||||||||||||||||||

.jpg)

