醫療器材法規、驗證與確效技術人員實務-全系列
醫療器材法規、驗證與確效技術人員實務-全系列

醫療器材法規、驗證與確效技術人員實務-全系列
課程型態/ 混成(實體+線上同步)
上課地址/ 中科_工商行服務大樓4樓或9樓教室【台中市428大雅區中科路6號】或 WEBEX線上直播
時數/ 36小時
起迄日期/ 2023/05/25~2023/07/20
聯絡資訊/ 陳文幸 04-25672316
報名截止日/ 2023/05/24
------------------------------

課程內容
單元一:QMS 與 ISO 13485 醫療器材品質管理系統是目前國內與國際醫材產業對於製造業者所依據的重要標準,其要求在醫材生命週期的一個或多個階段的組織所採用,從產品開發到上市與上市後之醫材全生命週期的解析與說明。
單元二:進入產品開發最重要的評估過程,醫材風險管理與可用性評估,此單元提供醫材製造業者,於產品設計之初,藉了解預期使用者,進行風險分析,導入設計考量,並加以驗證,充分掌握產品,開發出安全、有效、容易操作的醫療器材,增加產品安全性及使用滿意度,以及減少培訓和用戶服務需求或投訴,並於醫材研發前期及全生命週期即能導入風險管理標準之流程。
單元三:MDR的符合是為進入歐盟市場的必須要求,為確保醫療器材在生命週期裡的安全及功效,並更有系統性地管理欲在歐盟市場銷售後之醫療器材。課程詳細介紹歐盟醫療器材法規條文要求與技術文件要求,讓學員可充分瞭解新版MDR的重點及如何準備,並透過實際演練提升學員學習成效。
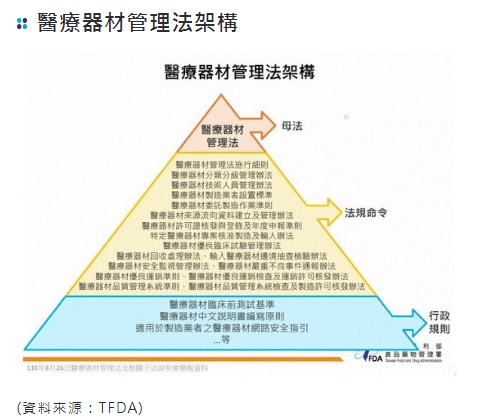
課程介紹
*本課程歡迎企業包班 ~請來電洽詢 課程承辦人陳小姐(Joan) 04-25675621,謝謝!
◆本課程符合勞委會"協助事業單位人力資源提升計畫"的補助方案,歡迎企業踴躍報名參加。
◆以下為【醫療器材法規、驗證與確效技術人員實務系列】~歡迎您一同報名參加:(點選課程名稱可連結至課程)
|
單元 |
代碼 |
課程日期 |
課程專區 |
時數 |
|
◆醫療器材法規、驗證與確效技術人員實務-全系列 |
A1-C3 |
112/5/25-07/20 |
6 |
|
|
◆單元一:新手上路(1天) QMS暨ISO13485醫療器材品質管理及法規架構 |
A1 |
112/5/25 |
6 |
|
|
◆單元二:實力養成(2天) 醫療器材安全與功效驗證 |
B1 |
112/06/08 |
6 |
|
|
B2 |
112/06/15 |
6 |
||
|
◆單元三:進階養成(3天) |
C1 |
112/07/06 |
6 |
|
|
C2 |
112/07/13 |
◆ISO 13485:2016 A11: 2021 暨 CEN/TR 17223:2018 MDR與ISO13485之調和實務 |
6 |
|
|
C3 |
112/07/20 |
6 |
課程大綱-單元1(A1)
單元一(A1):QMS暨ISO13485醫療器材品質管理及法規架構
ISO 13485與QMS 是針對醫療器材產業的品質管理系統標準,其標準規定了品質管理系統的要求,這些要求能夠被參與到醫療器材生命週期的一個或多個階段的組織所採用,包括醫療器材設計和開發、生產、儲存和銷售、安裝、服務、最終停用和處置,以及相關活動的設計開發或提供。
本課程將針對主管機關對醫療器材製造廠的期待與稽查重點、醫療器材上市法規架構與品質管理系統的關聯性為主軸切入解析 ISO 13485與QMS 法條要求,導入實施說明與常見缺失分享案例。
|
課程日期 |
課程大綱 |
|
112/5/25 (週四) 09:30~16:30 |
1. QMS暨ISO 13485:2016簡介 2. QMS暨ISO13485:2016之差異 3. QMS暨ISO 13485:2016條文說明 4. 常見缺失案例 |
課程大綱-單元二(B1)
單元二(B1):ISO 24971暨ISO 14971醫材風險管理報告撰寫實務
本課程針對國際醫療器材風險管理標準,ISO 14971:2019 & ISO 24971:2020新版強化風險管理計劃的流程敘述及要求,講師提供精闢說明與實務分享,促使醫療器材相關從業人員及醫材製造業者對於風險管理更具基本概念及實務應用能力。
|
課程日期 |
課程大綱 |
|
112/6/08 (週四) 09:30~16:30 |
1. ISO 14971:2012 與 ISO 14971:2019 之 差異 2. ISO 14971:2019 & ISO 24971:2020 風險管理流程說明 3. 如何將 ISO 14971:2019 & ISO 24971:2020 之要求整合⾄ ISO 13485:2016 4. 利⽤風險管理展現醫材基本安全功效要求之符合性 5. 上市後活動與風險管理流程持續運作之關係 |
課程大綱-單元二(B2)
單元二(B2):IEC 62366-1 暨 醫材可用性工程撰寫實務
本課程說明與介紹IEC 62366-1:2015條文內容,以及TFDA、FDA對於人因工程的要求,讓醫療器材相關人員充分了解可用性評估及人因工程上的實務要求,在開發初期成功地導入可用性並配合風險管理手法,符合用性評估及人因工程要求。
|
課程日期 |
課程大綱 |
|
112/6/15 (週四) 09:30~16:30 |
1. IEC 62366 範圍 2. IEC 62366 術語及定義 3. IEC 62366 可用性評估原則與方法 4. IEC 62366 可用性工程過程 5. TFDA 醫療器材人因 可用性工程評估指引 |
課程大綱-單元三(C1)
單元三(C1):歐盟MDR(2017/745) 暨 技術文件實務
本課程詳細介紹歐盟醫療器材法規MDR條文要求,讓學員們可充分瞭解新版歐盟醫療器材法規的重點及如何準備技術文件計畫及報告之撰寫。在產品開發初期就導入MDR規範,提早滿足MDR法規的要求。透過實際演練,讓學員可以加深瞭解法規的要求,並可提升學習成效,有效縮短準備技術文件之時程。
|
課程日期 |
課程大綱 |
|
112/7/06 (週四) 09:30~16:30 |
1. 歐盟醫療器材法規(MDR)重要條文 2. 一般安全和性能要求之實務 3. 技術文件之撰寫實務 4. 上市後監督之撰寫實務 |
課程大綱-單元三(C2)
單元三(C2):ISO 13485:2016 A11: 2021 暨 CEN/TR 17223:2018 MDR與ISO13485之調和實務
本課程詳細介紹歐盟醫療器材法規MDR與ISO 13485:2016 A11: 2021暨CEN/ TR 17223:2018的要求差異,讓學員們可充分瞭解新版歐盟醫療器材法規的重點及如何調和ISO 13485:2016的醫材品質管理系統,以符合MDR法規的要求。透過實際演練,讓學員可以加深瞭解ISO 13485:2016 A11: 2021暨CEN/ TR 17223:2018的要求,並可提升學習成效。
|
課程日期 |
課程大綱 |
|
112/7/13 (週四) 09:30~16:30 |
1. 醫療器材製造業者之調和重點 2. MDR 第 10 條與 ISO 13485: 2016 差異調和(表ZA.1) 3. MDR 附件 IX 與 ISO 13485:2016 差異調和(表ZA.2) 4. MDR 附件 XI 與 ISO 13485:2016 差異調和(表ZA.3) |
課程大綱-單元三(C3)
單元三(C3):歐盟MEDDEV 2.7.1 rev4醫材臨床評估CER撰寫實務
本課程說明醫療器材臨床評估指引( MEDDEV 2.7.1 rev4 )讓學員了解製造商如何進行臨床評估報告,並利用臨床評估報告按部就班演練各階段之進行方式,包含範圍界定與計畫、識別相關資料、評議相關資料、分析臨床資料、臨床評估報告PMS/PMCF計畫、類似產品對等性比較等;此外,對上市後臨床追蹤指引( MEDDEV 2.12-2 )說明其基本要求,以幫助學員對撰寫臨床估報告有所助益。
|
課程日期 |
課程大綱 |
|
112/7/20 (週四) 09:30~16:30 |
1. General principle of clinical evaluation 2. Stage o f a clinical evaluation 3. A2 & MDR :CI/CT be carried out ? 4. Appendices of MEDDEV 2.7.1 Rev 4 5. A9 臨床評估報告範例 6. 臨床評估 CER 撰寫要點 |
講師簡介
石老師
專長:
具講師具有全球醫材法規註冊及品質管理系統認證之輔導與撰寫經驗,同時具備衛生主管機關(TFDA 及 CDE)醫材註冊、臨床試驗、及醫學中心人體試驗計畫審查15年以上豐富經驗,亦具醫療器材臨床實務10年之豐沛量能。
現任:
中華民國醫療器材商業公會 顧問、台灣生技醫療照護輔具協會 顧問、虎尾科大生醫植入物聯盟 顧問、三軍總醫院育成中心 委員、成大醫學中心IRB 諮詢專家、馬偕醫學中心IRB 專家顧問、中醫大學安南醫院IRB 諮詢專家、醫療系統協會法規委員會副召集人。
經歷、證照與學歷:
成大前瞻醫材科技中心 法規顧問、普惠(台灣/越南)公司 副總/法規長、醫藥品查驗中心派TFDA 研究員、原子能委員會國家考試 輻射防護師、成大電機博士、中原醫工碩士、成大暨中原 斐陶斐榮譽協會會員。
價格
●本課程符合勞委會"協助事業單位人力資源提升計畫"的補助方案,歡迎企業踴躍報名參加
|
類別 |
單元報名 (6小時) |
全系列 (36小時) |
|
課程原價 |
$4,500元/人 |
$27,000元/人 |
|
7天前報名~享早鳥優惠價 |
$3,900元/人 |
$21,500元/人 |
|
二人(含)以上相揪同行/工研人/學校報名~享優惠價 |
$3,600元/人 |
$20,900元/人 |
結訓與證書(全系列)
- 凡參加<醫療器材法規、驗證與確效技術人員實務系列>之學員
1. 研習期滿,出席率超過80%(含)以上,且經考試成績合格者,即可獲得工研院頒發之培訓證書。
2.測驗平均總成績在60分(含)以上為合格。
報名方式及繳費方式
(可單元報名或全系列報名)
●上課日期:(單元一)112/5/25(週四)、(單元二)112/6/08、6/15 (週四)、(單元三)112/7/06、7/13、7/20 (週四)
●上課時間:09:30~16:30;每單元6小時,全系列共計36小時
-----------
●上課地點:工研院產業學院 台中學習中心-訓練教室 或 webex線上直播 (實際上課教室請依據上課通知函為準!)
●上課地址:台中市大雅區中科路6號(中科-工商服務大樓-4樓或9樓教室)
●上課地圖(公設場地):https://reurl.cc/xObA0N
●交通資訊: (台中市民-使用【悠遊卡】、【一卡通】 搭乘台中市區公車-10公里內免費)
-可搭乘『高鐵接駁公車:161路』:高鐵台中站至中科管理局工商服務大樓往返 (平日/假日均行駛)
-或搭乘『中科免費巡迴巴士(西屯線)』:統聯中港轉運站至中科管理局工商服務大樓往返(平日行駛)
-搭乘仁友客運:45路、巨業客運:68路、台中客運:69路、統聯客運:77路/79路(平日行駛)
-中科管理局近250個地下室平面停車位,停車便利,憑『車牌辬識』入場,本單位貼心免費消磁
-----------
●預計招生名額:25名為原則,依報名及繳費完成之順序額滿為止(本班預計10人即開課)
●報名方式:
1.線上報名:請點選頁面右上角「線上報名」
2.電子郵件報名:itri533882@itri.org.tw
●課程洽詢:(04)2567-2316 陳小姐 /(04)2568-7661 陳小姐
-----------
●繳費資訊:
(一)ATM轉帳(線上報名):
繳費方式選擇「ATM轉帳」者,系統將給您一組轉帳帳號「銀行代號、轉帳帳號」,但此帳號只提供本課程轉帳使用, 各別學員轉帳請使用不同轉帳帳號!!轉帳後,寫上您的「公司全銜、課程名稱、姓名、聯絡電話」與「收據」傳真至04-25690361工研院產業學院 台中學習中心 收。
(二)信用卡(線上報名):
繳費方式選「信用卡」,直到顯示「您已完成報名手續」為止,才確實完成繳費。
(三)銀行匯款(公司或個人電匯付款):
土地銀行工研院分行,帳號156-005-00002-5(土銀代碼:005)。
戶名「財團法人工業技術研究院」,請填具「報名表」與「收據」回傳真至04-25690361工研院產業學院 台中學習中心 收。
(四)計畫代號扣款(工研院同仁):
請從產業學院學習網直接登入工研人報名;俾利計畫代號扣款。
※繳費後請於收據上註明「公司名稱、課程訊息、姓名、聯絡電話」,傳真至產業學院 04-25690361陳小姐 收
注意事項
◆以下注意事項─敬請您的協助,謝謝!
1、課程3天前,學員將收到【E-mail上課通知】,敬請留意信件。
2、為尊重講師之智慧財產權,請勿錄影、錄音,恕無法提供課程講義電子檔。
3、請註明服務機關之完整抬頭,以利開立收據;未註明者,一律開立個人抬頭,恕不接受更換發票之要求。
4、若報名者不克參加者,可指派其他人參加,並於開課前一日通知。
5、退費辦法:學員於開訓前退訓者,將依其申請退還所繳上課費用90%,另於培訓期間若因個人因素無法繼續參與課程,將依上課未逾總時數1/3,退還所繳上課費用之50%,上課逾總時數1/3,則不退費。
附件


