醫療器材設計開發及設計管制
設計管制的主要目的不只是法規要求,而是一套來用幫助產品團隊保持紀律的優良設計規範


|
醫療器材設計開發及設計管制 課程型態:混成(實體+線上同步) 時數:12 起迄日期:2022-03-04~2022-03-18 聯絡資訊:陳小姐/03-5732407 報名截止日:2022-03-01 課程類別:人才培訓(課程) 活動代碼:2321090028 |
||||
課程介紹美國FDA查廠時,查廠人員所觀察到90%的問題來自於品質系統法規(21 CFR 820),其中設計管制(21 CFR 820.30 design control)方面就佔了14%,與矯正預防措施(21 CFR 820.100 CAPA)一樣多,也就是說兩者在品質系統中的問題都是排名第一。
(Form 483在查廠檢查時所用的表格,是用於記錄和傳達在查廠檢查過程中所發現的問題,也就是FDA 483s觀察結果。製造商有義務在15天內以書面形式回應FDA寄出的FDA 483觀察結果,若回覆的不適當,或是後續改善措施失當,483觀察結果將會被FDA升級為警告信(warning letter),就不能在進入美國市場了。
所以建立穩固的設計控制流程可以避免未來遇到FDA查廠時被當掉的悲劇。
設計管制的主要目的不只是法規要求,而是一套來用幫助產品團隊保持紀律的優良設計規範(good design practice)或稱為優良工程實踐(good engineering practice),確保在研發過程中產出高品質的解決方案。
傳統的設計管制法規課程注重條文要求,難免抽象,因為是從上到下解說(top-down),你會發現上完都聽得懂,也問不出太多問題,但回到公司後設計管制還是離我日上的做很遠,難以執行。
我們設計了這個課程,目的是想帶大家反過來從下往上看(bouton-up),從產品團隊熟悉的語言還有工作上會遇到的內容,系統性地帶大家來了解設計管制。
法規是寫死的,但原則可以被活用。懂得如何掌握原則,設計團隊自然能思考出一套適用的設計管制,用最小時間成本留下珍貴的設計歷史檔案,而不是等到做完了,再回過頭來回憶來補這些文件。
*工研院產業學院為衛福部核可辦理醫材人員訓練及認證之合格單位,本課程完訓後可申請時數認證,惟實際申請仍以衛福部查核結果為準,敬請學員踴躍報名。 *因應中央疫情防疫規定,本場次課程將以「實體舉辦」為主,後續將視中央疫情規定保留調整為「線上辦理」之權利,實際上課資訊請依上課通知為準。 課程目標
課程對象與醫療器材產品有關的團隊:產品經理、專案經理、研發/工程、製造/生產、品保、法規等。
講師簡介俞力平 博士 (Irving Yu)
−樂證科技資深顧問 / EU MDR法規長
−醫療器材法規小學堂
−專長:歐盟MDR、安全與風險管理、可用性工程、設計管制
−授課經驗:
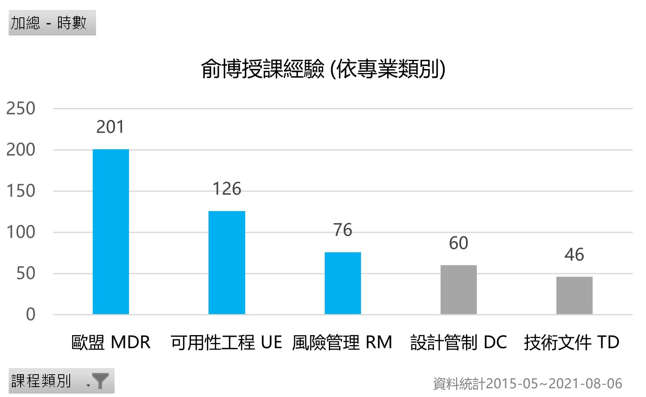 課程範圍
課程大綱
※ 執行單位保留調整課程內容之權利 課程特色
課程售價原價:每人新台幣$12,000元整
特惠價:每人$9,600元整 早鳥優惠價:開課前14天報名優惠價:每人$9,200元整
工研人優惠價:每人$ 9,000元整 同單位2人團報優惠價:每人$ 8,400元整
同單位3人(含以上)團報優惠價:每人$ 7,900元整 ※本課程歡迎企業包班,敬請企業來電洽詢課程承辦人。
付款方式(一)ATM轉帳(線上報名):
繳費方式選擇「ATM轉帳」者,系統將給您一組虛擬帳號「銀行代號、轉帳帳號」,此帳號只提供本次課程轉帳使用,各別學員轉帳請使用不同轉帳帳號。
(二)信用卡(線上報名):
繳費方式選「信用卡」,直到顯示「您已完成報名手續」為止,才確實完成繳費。
(三)銀行匯款(公司或個人電匯付款):
主辦單位將於確認開班後通知您相關匯款帳號,請您繳費後回傳相關收據給 yijie@itri.org.tw 陳小姐。
貼心提醒※以下注意事項 ─ 敬請欲報名者多多協助,感謝您!
1. 為確保您的上課權益,報名後若未收到任何回覆,請來電洽詢方完成報名。
2. 若報名者不克參加者,可指派其他人參加,並於開課前2日通知。
3. 因課前教材、講義及餐點之準備,若您不克前來須取消報名,請於開課前3日以E-mail或電話通知主辦單位聯絡人確認申請退費事宜,學員於開訓前退訓者,將依其申請退還所繳上課費用90%,另於培訓期間若因個人因素無法繼續參與課程,將依上課未逾總時數1/3,退還所繳上課費用之50%,上課逾總時數1/3,恕不退費。
4. 為尊重講師之智慧財產權益,無法提供課程講義電子檔。
5. 為配合講師時間或臨時突發事件,主辦單位有調整日期或更換講師之權利。
6. 繳費方式為信用卡、ATM轉帳,無法受理現場報名和繳費。
|


